Wie Trifluoressigsäure aus dem Abbau einiger F-Gase in der Natur vorkommt und sich völlig von den meisten PFAS unterscheidet
Das UNEP Environmental Effects Assessment Panel (EEAP) umfasst in seinem jüngsten wissenschaftlichen Update 2021 eine umfangreiche Zusammenfassung für Trifluoressigsäure (TFA) und weist darauf hin, dass die meisten PFAS andere Eigenschaften als TFA haben. Beim Abbau einiger FKW und einiger HFO gelangen TFA in die Atmosphäre. Hier sind einige einfache Fakten und Diagramme, die erklären, warum dies so ist. Auf die umfangreiche Zusammenfassung des EEAP wurde im EFCTC-Newsletter vom März hingewiesen.
Definitionen: TFA steht für Trifluoressigsäure und ihre Salze, das fluorierte Äquivalent der in Essig vorkommenden Essigsäure. TFA ist ein natürlicher Stoff, von dem über 200 Millionen Tonnen in den Ozeanen und in der Hydrosphäre vorhanden sind. Per- und Polyfluoralkylsubstanzen („PFAS“) umfassen ein breites Spektrum von [anthropogenen] Substanzen ab, die nach derzeit akzeptierter Terminologie mindestens eine Perfluoralkylgruppe enthalten.
Warum sind einige PFAS besonders besorgniserregend? Zunächst standen langkettige Perfluoralkylsäuren (PFAA) und deren Vorstufen im Fokus, insbesondere Perfluoroctansäure (PFOA) und deren Derivate sowie Perfluoroctansulfonsäure (PFOS) und deren Derivate. Langkettige PFAA werden in der Regel als hochpersistent (P), bioakkumulierend (B) und toxisch (T) identifiziert, sind überall in der Umwelt verbreitet und sind als globale Kontaminanten, die Anlass zu großer Besorgnis geben, anerkannt. Im Gegensatz dazu konzentriert sich TFA nicht in aquatischen Organismen, unterliegt keiner Biomagnifikation in der Nahrungskette, und TFA-Salze sind unter umweltrelevanten Bedingungen von geringer akuter Toxizität für Säugetiere.
Warum unterscheiden sich die Eigenschaften von TFA und langkettigen PFAA so sehr? Der Oktanol/Wasser-Verteilungskoeffizient (KOW) ist ein wichtiger Parameter in Studien über das Umweltverhalten chemischer Stoffe. Er wird üblicherweise als Log KOW mit Werten zwischen -3 (sehr hydrophil) und +10 (extrem hydrophob) ausgedrückt. Log KOW ist relevant für die Verteilung zwischen Wasser und Sedimenten, Bodenadsorption, biologische Aufnahme, lipophile Lagerung und Biomagnifikation.
• Hoher Log KOW: stärkere Neigung zur Verlagerung in organische Phase
• Niedriger Log KOW: stärkere Tendenz zur Verlagerung in wässrige Phase
• Bei diesen Säuren folgen Wasserlöslichkeit und Log KOW denselben Trends
| PFOA hat eine sehr hydrophobe langkettige perfluorierte Gruppe und ist eine starke Säure, da die perfluorierte Gruppe es zu einem wirksamen Tensid mit geringer Wasserlöslichkeit macht. Es hat einen hohen Wasser/Octanol-Verteilungskoeffizienten KOW |
|
| TFA ist nicht hydrophob, sondern eine starke Säure und sehr gut wasserlöslich.Sie hat einen niedrigen Wasser/Octanol-Verteilungskoeffizienten KOW, etwa 2000 mal niedriger als PFOA. In Wasser ist sie als Perfluorcarboxylat CF3COO- vorhanden. |  |
Vergleich von Perfluorcarbonsäuren und den Acetaten hinsichtlich Wasserlöslichkeit und Log KOW
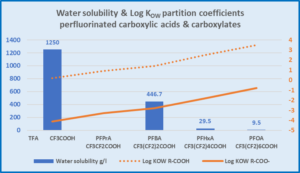 |
TFA sehr gut wasserlöslich, TFA-Acetat hat sehr niedrigen KOW Mit zunehmender Kettenlänge nimmt die Wasserlöslichkeit ab und steigt der KOW PFOA hat eine geringe Wasserlöslichkeit und einen hohen KOW, der etwa 2000 mal höher ist als TFA. |
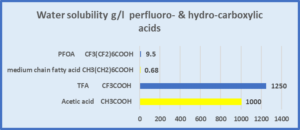
Vergleich von Perfluorcarbonsäuren und Carbonsäuren
| Essigsäure hat ganz andere Eigenschaften als Octansäure, eine Fettsäure mit mittlerer Kettenlänge. TFA-Trifluoressigsäure hat ganz andere Eigenschaften als PFOA, Perfluoroctansäure. |
 |
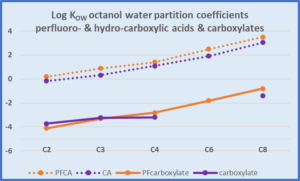 |
Trifluoressigsäure und Essigsäure haben beide folgende Eigenschaften: • sehr hydrophil • hohe Wasserlöslichkeit • niedriger Log KOW der Säuren • sehr niedriger Log KOW der Carboxylate TFA liegt nur als Carboxylat CF3COO- vor, da es sich um eine starke Säure handelt. |